Серед всіх випадків первинного раку печінки 90% становить гепатоцелюлярний рак.
Епідеміологія первинного раку печінки Гепатоцелюлярний рак печінки займає 5-е місце у чоловіків і 8-е місце у женшін серед усіх злоякісних новоутворень в світі. Однак поширеність його широко варіює в різних країнах. За орієнтовними підрахунками, у світі щорічно реєструється понад 500 ТОВ нових випадків гепатоцелюлярного раку печінки і 85% з них спостерігається в країнах з високим ступенем інфікованості гепатитом В (країни Південно-Східної Азії, Центральної Африки). Тому в Європі і США захворюваність гепатоцелюлярний рак печінки становить 2-7, в той час як на Тайвані, в Південно-Східному Китаї і Японії вона досягає 23-40 на 100 000 населення. У країнах Центральної Африки (Сенегал, Замбія) цей показник дорівнює 26 (дані IARC, 1994). У Росії захворюваність гепатоцелюлярний рак печінки становить 4,9 у чоловіків і 2,2 у жінок, але вона також значно варіює залежно від регіону. Так, в Центральному регіоні Росії цей показник становить 3,5 у чоловіків і 1,6 у жінок, в той час як на Далекому Сході захворюваність зростає до 8,4 і 3,5 відповідно, в Чукотському АТ досягає 10,6, а в Республіці Саха (Якутія) навіть 17,2.
гепатоцелюлярний рак печінки частіше виникає на тлі цирозу. У великих серіях спостережень серед хворих гепатоцелюлярний рак печінки більш ніж в 80% випадків мав місце попередній цироз печінки. Найчастішою причиною розвитку цирозу є гепатити В і С, тому багато дослідників фокусують свою увагу саме на цих захворюваннях. Алкогольний цироз печінки також призводить до розвитку гепатоцелюлярного раку печінки, але в набагато меншому ступені, ніж при гепатитах В і С. Спадковий гемохроматоз, тирозинемия і інші рідкісні види хронічних захворювань печінки також мають тенденцію до виникнення гепатоцелюлярного раку печінки, але з огляду на їх відносної рідкості питома вага раку, який виник на їх фоні, порівняно невеликий.
Гепатит В
Вірусний гепатит В (HBV) залишається одним з найважливіших факторів, що призводять до розвитку гепатоцелюлярного раку печінки. За даними ВООЗ, до теперішнього часу в світі налічується 350 млн. Людей, у яких в крові визначається поверхневий антиген гепатиту В (11 UsAg). Більшість з цих хворих інфікувалися або в дитячому віці, або перинатально. В результаті від 10 до 20% населення Південно-Східної Азії і Південної Африки є носіями 11 UsAg. У той же час в країнах Європи, США, а також низці інших жономіческі більш розвинених регіонів кількість осіб, інфікованих вірусом гепатиту В, відносно невелика, але найголовніше, інфікування відбувається в набагато пізніх вікових г Руппі в основному через компоненти крові, при ін'єкції лікарських препаратів і статевим шляхом.
Механізми, завдяки яким HBV вислизає від імунного нагляду і персистує у хронічних носіїв, невідомі, але певний внесок в цей феномен можуть давати мутації в геномі самого вірусу.
Гепатит С
Іншим фактором ризику виникнення гепатоцелюлярного раку печінки, виступаючим в останні роки на перше місце, є вірусний гепатит С (HCV). Зв'язок його з виникненням раку виявлено пізніше в порівнянні з HBV, так як сам вірус був відкритий тільки в 1989 р Як при HBV-, так і при HCV-гепатитах, часовий інтервал між зараженням вірусом і розвитком гепатоцелюлярного раку печінки досить тривалий і становить в середньому 29 років. Грубо кажучи, серед HCV-інфікованих осіб у 20-25% пацієнтів розвинеться цироз печінки, а з них у 20-25% виникне гепатоцелюлярний рак печінки.
HCV є причиною збільшення частоти гепатоцелюлярного раку печінки в багатьох регіонах світу, включаючи Західну Європу, США, Японію. У кожній з цих зон, де захворюваність гепатоцелюлярний рак печінки в цілому низька, з вірусом гепатиту С пов'язано більше 50% випадків гепатоцелюлярного раку печінки. У Росії ж за останнє десятиліття не тільки не відзначається зростання захворюваності на первинний рак печінки, але є тенденція до її зниження. Так, в 1990 р захворюваність була 6,0 на 100 тис. Населення у чоловіків і 2,5 — у жінок, в 1996 р ці показники склали відповідно 5,9 і 2,6, а в 2000 р — 4, 9 і 2,2 (Давидов М.І., Аксель Е.М., 2002).
Алкоголь. Алкогольний цироз, за поданням більшості дослідників, грає меншу роль як причинний фактор хвороби в порівнянні з гепатитами В і С, але до теперішнього часу немає великих серій проспективно простежених хворих з алкогольним цирозом. Всі дані, на основі яких базується зв'язок між цими двома захворюваннями, отримані при вивченні частоти наявності алкогольного цирозу у хворих гепатоцелюлярний рак печінки. Дані, що стосуються захворюваності гепатоцелюлярного раку печінки при алкогольному цирозі, малопереконливі, справжня роль його повинна ще бути вивчена проспективних дослідженнями.
Афлатоксин. Афлатоксин В, (AFB,) виробляється пліснявими грибами Aspergillusflavus і Aspergillus parasiticus. Ця речовина метаболізується, перетворюючись на епоксид, який і викликає генетичні мутації. Люди піддаються контакту з AFB ,, вживаючи в їжу заражені грибами рис, пшеницю, горіхи або продукти тваринного походження, якщо тварини отримували заражений корм. Ризик розвитку гепатоцелюлярного раку печінки знаходиться в прямій пропорційній залежності від споживання AFB, з їжею. Розрахункова середня токсична доза AFB, для розвитку раку у людини оцінюється на рівні 132 мкг / кг / сут. Найбільший контакт з AFB, характерний для населення Південно-Східної Африки і південних районів Китаю. В останні роки розроблені відмінні маркери, що свідчать про вплив афлатоксину на організм, що сприяло проведенню добре організованих проспективних досліджень. На підставі цих досліджень представляється, що афлатоксин сам по собі може викликати підвищення частоти розвитку гепатоцелюлярного раку печінки, але в поєднанні з хронічною вірусною інфекцією канцерогенний ефект буває значно виражено.
Чи обмінюється гепатоцелюлярного раку печінки з гемохроматозом, тирозинемії.
Найбільше практичне значення серед первинних злоякісних пухлин печінки має первинний рак печінки. Макроскопічно він представлений масивної, вузловий і дифузійної формами. Ця класифікація запропонована H.Eggel в 1901 р, Її дотримується більшість дослідників, і вона використовується до теперішнього часу.
Масивна форма первинного раку печінки має два варіанти. У першому вона представлена одним великим вузлом (масивна проста форма), у другому — одним великим вузлом з метастазами по периферії (масивна форма з сателітами).
Вузлова форма раку — в паренхімі печінки зазвичай знаходять кілька порівняно однакових за розміром пухлинних вузлів, розташованих в одній або обох частках печінки. Вирішити, який з пухлинних вузлів є основним, не представляється можливим. Навколо основних великих вузлів можуть бути дрібні, по всій ймовірності, метастатичні вузли. Іноді в печінці знаходять дрібні пухлинні вузлики однакового розміру, розкидані по всьому органу. У центрі пухлинних вузлів, як великих, так і дрібних, спостерігаються вогнища некрозу з крововиливами. Можливо злиття окремих вузлів і утворення великих конгломератів найрізноманітнішої форми.
Сузір'я макроскопічна форма за зовнішнім виглядом і деякими іншими ознаками значно відрізняється від двох попередніх форм. Вона зустрічається рідше попередніх видів, представлена у вигляді нерівномірної інфільтрації печінки або множинними дрібними пухлинними вузлами, Струд диференціюють від вузлів регенераторной гіперплазії, причому у всіх хворих є ураження обох часток і в більшості випадків протікає на тлі цирозу печінки.
Мікроскопічні форми первинного раку печінки. Гепатоцелюлярний рак (печінково-клітинний рак, гепатома, злоякісна гепатома) зустрічається в основному у дорослих і складає 58-76% всіх первинних злоякісних пухлин печінки. Злоякісна пухлина утворена клітинами, що нагадують гепатоцити. У чоловіків зустрічається в 2 рази частіше, ніж у жінок. Нерідко поєднується з цирозом печінки. Колір пухлинної тканини залежить від секреції жовчі, ділянок крововиливів, некрозу і може змінюватися отсеровато-білого до зеленувато-коричневого. Для гепатоцелюлярного раку печінки більш характерна м'яка консистенція пухлини. Щільна консистенція свідчить про наявність грубої коллагеновой строми.
Мікроскопічно найбільш частим варіантом є трабекулярной, при якому пухлинні клітини виглядають більшими і нішь в рідкісних випадках дрібніше нормальних гепатоцитів. Крім цього варіанту в хвороби можна виявити ацінарние, тубулярні, папілярні і тиреоїдні структури. Відповідно до класифікації ВООЗ, рекомендується виділяти псевдозалозисті (ацинарна), компактний і скірозний варіанти.
псевдозалозисті варіант характеризується наявністю різноманітних железістоподобних структур у вигляді канальців, іноді містять в отворах жовч, кістозно розширених порожнин, заповнених фібринозним ексудатом, клітинним детритом або гомогенним речовиною, що нагадує колоїд і надає схожість з фолікулами щитовидної залози. При компактному варіанті пішло тісне прилягання трабекул один до одного, в результаті чого синусоїди стають майже не помітними і пухлина має будову солідного пласта. З кіррозний варіант найчастіше відповідає трабекулярную з рясною фіброзної стромою, розділеної тяжами пухлинних клітин.
У рідкісних випадках може зустрічатися гепатоцелюлярний рак печінки з грубої коллагеновой стромой, так званий фіброламеллярний варіант. Він вперше був описаний R.Peters в 1976 г. При цій формі клітини пухлини полігональні з виразними ядрами, що містять одиничні ядерця, цитоплазма еозинофільна, зерниста. Поліморфізм клітин виражений слабо, мітози поодинокі. Строма пухлини має вигляд тонких тяжів і пластинок, які поділяють клітини на окремі вузли. Часто є капсула. У цитоплазмі клітин нерідко визначаються жовчний пігмент, жир, гіалінові тільця. При електронній мікроскопії в клітинах пухлини багато мітохондрій, філаментних структур і великих пероксисом.
Мікроскопічна картина Гепатоцелюлярний рак печінки може залежати і від цитологічних ознак, у зв'язку з чим виділяють печеночноподобний, світлоклітинний, плеоморфние , веретеноклеточний і інші варіанти.
При печеночноподобном типі клітини пухлини нагадують гепатоцити. Ступінь подібності варіює залежно від рівня диференціації клітинних елементів пухлини. Пухлинні клітини полігональної форми з кулястими ядрами і чітко обумовленими ядерця. Між сусідніми пухлинними клітинами часто виявляються кільцеподібні структури.
Для плеоморфние варіанту характерні виражений клітинний і ядерний поліморфізм, наявність химерних гігантських і багатоядерних клітин. Світлоклітинний варіант характеризується наявністю пухлинних клітин, цитоплазма яких багата глікогеном або ліпідами, що надає пухлини схожість зі світлоклітинним раком нирки.
Слід зазначити, що будь-яких істотних відмінностей між типом будови і епідеміологічними, біологічними і клінічними характеристиками пухлини до сих пір не виявлено.
Як при МЦД, так і ХЦР нерідко настає інвазія судин, іноді з утворенням пухлинних тромбів в гілках ворітної вени, включаючи тромбоз її основного стовбура. У цих випадках розвивається портальна гіпертензія з подальшою декомпенсацією функції • печінки. При тромбозі нижньої порожнистої і печінкових вен може розвинутися синдром Бадда-Кіарі.
Серед наших хворих найбільш частим варіантом хвороби також з'явився трабекулярной (37%). Клітини пухлини мали широку еозинофільну, злегка гранульовану цитоплазму і складалися в трабекули різної ширини: частіше 4-6 клітин, рідше 10-15. Трабекули розділені синусоїдами, покритими сплощеним епітелієм. За домінуванням тієї чи іншої структури виділені форми: аденоїдної-псевдозалозисті (7,1%), компактна (10,4%), скірозний (3,3%), фіброламеллярний рак (7,9%). Плеоморфние варіант мався на 17,1% випадків, світлоклітинний — в 9,2%.
Холангіоцеллюлярний рак (холангіокарцинома, холангіома, рак жовчних проток) — злоякісна пухлина печінки, представлена клітинами, що нагадують епітелій жовчних проток. Зустрічається в 7-35% випадків всіх пухлин печінки, головним чином у віці 50-70 років, однаково часто у чоловіків і жінок. З цирозом печінки поєднується рідко.
Рідко зустрічаються формами раку є залозисто-плоскоклітинний і плоскоклітинний рак, джерелом розвитку яких вважають метаплазірованном епітелій жовчних проток.
Змішаний гепатохолангіоцеллюлярний рак містить явні елементи як МЦД, так і ХЦР. Для цього типу пухлини характерні продукція жовчі і ознаки секреції слизу. Подібна пухлина зустрічається вкрай рідко. На нашому матеріалі серед оперованих хворих було лише 1 спостереження.
гепатобластома становить 1-6% усіх злоякісних пухлин у дітей і 44-75% усіх злоякісних пухлин печінки у дітей. Пухлина представлена клітинами, подібними з примітивними клітинами паренхіми печінки або поєднанням цих клітин з мезенхімальними елементами. Виникає переважно у дітей до 2 років, нерідко поєднується з вродженими аномаліями розвитку. Зазвичай являє собою чітко обмежену, частково інкапсульовану пухлина. У дорослих спостерігається вкрай рідко. На 108 операцій, проведених в РОНЦ ім. Н.Н.Блохина РАМН з приводу первинних пухлин печінки, гепатобластома була в 2 випадках.
Мікроскопічно виділяють епітеліальний і змішаний (епітеліальних-мезенхімальний) варіанти гепатобластома. Епітеліальний компонент зазвичай складається з двох типів клітин — ембріональних і фетапьних. У складі гепатобластома змішаного типу крім епітеліального компонента можуть спостерігатися ділянки саркоми, частіше за все відповідні остеогенной саркомі, хондро- або рабдоміосаркома.
Клініко-анатомічна класифікація первинного раку печінки по TNM
В даний час використовується 5-е видання класифікації пухлин (1998 г.), що повністю відповідає 5-му виданню AJCC Керівництва за стадіювання раку ( 1997 г.) і схвалене всіма національними комітетами TNM. Класифікація застосовна тільки для первинного МЦД і ХЦР.
Т — первинна пухлина
Тх — недостатньо даних для оцінки первинної пухлини ТО — первинна пухлина не визначається
T1 — солітарна пухлина до 2 см у найбільшому вимірі без інвазії судин
Т2 — солітарна пухлина до 2 см у найбільшому вимірі з інвазією судин, або множинні пухлини до 2 см в найбільшому вимірі без інвазії судин, обмежені однією часткою, або солітарна пухлина понад 2 см у найбільшому вимірі без інвазії судин ТЗ — солітарна пухлина понад 2 см у найбільшому вимірі з інвазією судин, або множинні пухлини небільше 2 см в найбільшому вимірі з інвазією судин, обмежені однією часткою, або обмежені однією часткою множинні пухлини, кожна з яких понад 2 см з або без інвазії судин.
Т4 — множинні пухлини в обох частках, або пухлина, що вражає основну гілку портальної або печінкової вени, або пухлина з поширенням на сусідні органи, крім жовчного міхура, або пухлина, що проростає вісцеральну очеревину
N — регіонарні лімфатичні вузли (регіонарними є лімфатичні вузли воріт печінки, розташовані в гепатодуоденальной зв'язці)
Nx — недостатньо даних для оцінки регіонарних лімфатичних вузлів
N0 — лімфатичні вузли воріт печінки і зв'язки не вражені
N1 — є поразкалімфатичних вузлів воріт печінки або до-патодуоденальной зв'язки метастазами
М — віддалені метастази
МХ — недостатньо даних для визначення віддалених метастазів
МО — немає даних за наявність віддалених метастазів М1 — наявність віддалених метастазів
pTNM — патологічна класифікація
РТ, pN- і рМ-категорії відповідають
Т, N- і М-категоріям.
pNO — при гістологічному аналізі матеріалу регионарной лімфаденектоміі має бути досліджено не менше трьох лімфатичних вузлів
С — гістопатологічного диференціювання
Gx — ступінь диференціювання не може бути встановлена
G1 — високий ступінь диференціювання G2 — середній ступінь диференціювання G3 — низький ступінь диференціювання G4 — недиференційовані пухлини
Новини по темі:
 Печінка досить часто називають найбільш «мовчазним» з органів людського організму. Справа в тому, що проблеми, що виникли тут, можуть не давати про себе знати дуже довго, проявляючись лише в побічних реакціях, здавалося б, ніяк не пов'язаних з ним самим. До таких реакцій відноситься безліч захворювань. Довгий час медицині було невідомо
Печінка досить часто називають найбільш «мовчазним» з органів людського організму. Справа в тому, що проблеми, що виникли тут, можуть не давати про себе знати дуже довго, проявляючись лише в побічних реакціях, здавалося б, ніяк не пов'язаних з ним самим. До таких реакцій відноситься безліч захворювань. Довгий час медицині було невідомо 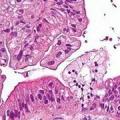 Якщо раніше вчені пов'язували рак виключно з генетичними порушеннями, якого б виду онкологія і не була на увазі, то сьогодні з великого списку захворювань з генетичною основою вийшов рак яєчників. Дослідники отримали дані про те, що даний вид раку розвивається також і в увазі надмірної кількості клітинного білка
Якщо раніше вчені пов'язували рак виключно з генетичними порушеннями, якого б виду онкологія і не була на увазі, то сьогодні з великого списку захворювань з генетичною основою вийшов рак яєчників. Дослідники отримали дані про те, що даний вид раку розвивається також і в увазі надмірної кількості клітинного білка

